Định nghĩa
Bệnh phổi mô kẽ do thuốc (Drug-induced interstitial lung disease, DIILD) xảy ra khi tiếp xúc với một thuốc gây viêm và cuối cùng gây xơ hóa mô kẽ phổi.
Bệnh phổi mô kẽ do thuốc là một chủ đề rất thách thức đối với cả lâm sàng và lí thuyết. Một số nhóm thuốc nhất định có xu hướng gây ra các kiểu tổn thương phổi giống và chồng chéo nhau.
Hơn 350 loại thuốc được biết gây bệnh phổi do thuốc, tần suất chính xác vẫn chưa rõ. Số lượng thuốc gây bệnh phổi chắc chắn sẽ liên tục tăng lên khi càng nhiều thuốc mới được phát triển.
Dịch tễ học
Xuất độ DIILD thay đổi giữa 4.1 – 12.4 ca/triệu người/năm. DIILD chiếm 3-5% các ca bệnh phổi mô kẽ (interstitial lung disease, ILD) lưu hành.
Thuốc điều trị ung thư, sau đó là thuốc điều trị thấp khớp, amiodarone và kháng sinh, là những nguyên nhân chính của DIILD
- Nguyên nhân/ yếu tố nguy cơ
Các thuốc gây bệnh thường gặp
- Thuốc điều trị ung thư
Thuốc ung thư là nguyên nhân hàng đầu của DIILD trong hầu hết các nghiên cứu, chiếm 23–51% các trường hợp, tiếp theo là các thuốc chống thấp khớp thay đổi diễn tiến bệnh (DMARDs) (6–72%), kháng sinh (6–26%), thuốc chống viêm non-steroid (NSAIDs) (0–23%), thuốc điều trị tâm thần (0–9%) và thuốc chống loạn nhịp tim (0–9%).
Bleomycin từng chủ yếu được dùng điều trị lymphoma Hodgkin và u tế bào mầm, gây tổn thương phổi thông qua tác động trung gian miễn dịch và tác động gây độc trực tiếp. Nguy cơ được báo cáo là 6.8-21%, tỉ lệ tử vong liên quan lên đến 48%.
- Thuốc điều trị thấp khớp
Trong thấp học, phân tích DIILD bị cản trở bởi sự lưu hành sẵn có của ILD, đặc biệt là ở người bệnh viêm khớp dạng thấp. Hơn nữa, nhiều thuốc chống thấp thay đổi diễn tiến bệnh (disease-modifying anti-rheumatic drugs, DMARDs) có tác dụng ức chế miễn dịch và liên quan với sự tăng nguy cơ nhiễm trùng cơ hội, đưa đến thách thức trong chẩn đoán phân biệt các triệu chứng hô hấp xấu đi.
Methotrexate (MTX) là thuốc chính trong thấp khớp học và cho điều trị lymphom và sarcom. Xuất độ của DIILD ở người bệnh viêm khớp dạng thấp với liều thấp MTX được báo cáo là 0.3-2.1%. DIILD do MTX có thời gian và tốc độ khởi phát thay đổi và dường như không phụ thuộc liều. Trong một nghiên cứu, 48% các ca phát triển trong vòng 32 tuần khởi trị.
- Kháng sinh
Nitrofurantoin thường được dùng cho điều trị và dự phòng nhiễm trùng tiểu. DIILD chiếm 16-48% các biến cố bất lợi liên quan nitrofurantoin được báo cáo.
Ở một nghiên cứu 447 ca DIILD liên quan nitrofurantoin ở Thụy Điển, hầu hết 90% là phản ứng cấp tính. Tỉ lệ nhập viện là 75%, tử vong 0.5% và 8% lần lượt cho người bệnh phản ứng phổi cấp và viêm phổi mô kẽ mạn tính.
- Thuốc chống loạn nhịp
Amiodarone là một trong những nguyên nhân phổ biến nhất gây DIILD, xuất độ được báo cáo 1.2-8.8% và tử vong 3-37%. Liều tích lũy là một yếu tố nguy cơ quan trọng cho DIILD do amiodarone, sự kết hợp liều cao và dùng trong thời gian dài liên quan mạnh với DIILD hơn từng yếu tố riêng lẻ.
Yếu tố nguy cơ của DIILD
Các yếu tố nguy cơ cho phát triển DIILD thay đổi dựa theo bệnh, thuốc và dân số. Các yếu tố nguy cơ nhất định có đặc điểm ưu thế qua từng thuốc
Tuổi: tuổi cao được xem là yếu tố nguy cơ đáng kể cho DIILD khi điều trị với bleomycin, gemcitabine, thuốc nhắm thụ thể EGFR, leflunomide, MTX, amiodarone và nitrofurantoin
Bệnh phổi trước đó: ILD hay xơ phổi vô căn có trước là yếu tố nguy cơ độc lập đối với DIILD
Hút thuốc lá: người hút thuốc lá có nguy cơ cao DIILD khi điều trị với gemcitabine, thuốc nhắm thụ thể EGFR và MTX
Liều thuốc: mối quan hệ phụ thuộc liều rõ ràng được công nhận với bleomycin, amiodarone và nitrofurantoin
Đặc điểm bệnh nền: trong ung thư, tình trạng hoạt động (performance status) kém và giai đoạn bệnh tiến triển hay di căn là yếu tố nguy cơ độc lập với DIILD
Giới tính: giới nam được báo cáo là yếu tố nguy cơ cho DIILD ở một số nghiên cứu điều trị với ức chế EFGR, pemetrexed, methotrexate và amiodarone
Các điều trị khác: đối với gemcitabine, hóa trị trước đó mang đến nguy cơ tương đối DIILD 1.45 lần. Xạ trị lồng ngực trước đó cũng tăng nguy cơ DIILD ở người bệnh ung thư phổi.
Các yếu tố nguy cơ khác: các yếu tố nguy cơ tiềm tàng DIILD gồm tính mẫn cảm di truyền, uống nhiều rượu, suy thận, đái tháo đường.
Bệnh học
4 cơ chế của thuốc gây tổn thương phổi
Tổn thương do oxi hóa, ví dụ như uống nitrofurantoin kéo dài.
Tác động độc tế bào trực tiếp (và những tác động này có thể bị làm trầm trọng thêm bởi tổn thương do oxy hóa).
Lắng đọng phospholipids trong tế bào, ví dụ như amiodarone.
Tổn thương qua trung gian miễn dịch thông qua lupus ban đỏ hệ thống gây ra do thuốc.
Bảng 1. Phân độ nặng được đồng thuận quốc tế dùng trong các thử nghiệm lâm sàng [9]
| Mức độ | Biểu hiện |
| Grade 1 (nhẹ) | Không triệu chứng, chỉ có biểu hiện trên hình ảnh học |
| Grade 2 (trung bình) | Có triệu chứng, không ảnh hưởng đến hoạt động hàng ngày |
| Grade 3 (nặng) | Có triệu chứng, ảnh hưởng hoạt động hàng ngày hoặc cần oxy |
| Grade 4 (đe dọa tính mạng hay tàn phế) | Đe dọa tính mạng hay cần thông khí hỗ trợ |
| Grade 5 (tử vong) |
Triệu chứng
Các triệu chứng DIILD không đặc hiệu, bao gồm ho, sốt, khó thở, ho máu, khò khè và đau ngực kiểu màng phổi. Biểu hiện lâm sàng thường gây nhầm lẫn với nhiễm trùng hô hấp và thường được điều trị ban đầu với kháng sinh. DIILD thường được xem xét khi không có cải thiện lâm sàng đáng kể với điều trị kháng sinh kinh nghiệm.
Thời gian khởi phát triệu chứng thì phần lớn phụ thuộc vào thuốc thủ phạm. Một số thuốc gây triệu chứng trong vòng vài ngày, trong khi số khác ví dụ như thuốc hóa trị gây độc tế bào cần đến vài tuần đến vài tháng, thậm chí hàng năm do phụ thuộc sự tích lũy liều.
Khám lâm sàng không đặc hiệu, dấu hiệu thường gặp gồm ran phổi “Velcro” khô, thi thoảng có ngón tay dùi trống. suy chức năng thất phải có thể có với tĩnh mạch cổ nổi và phù chân. Dấu hiệu của rối loạn tự miễn nên được đánh gia khi khám lâm sàng vì bệnh mô liên kết là một chẩn đoán phân biệt.
Chẩn đoán
DIILD được chẩn đoán khi
- Các dấu hiệu hình ảnh, sinh lí, lâm sàng phù hợp với ILD.
- Mối quan hệ thời gian giữa khởi phát triệu chứng và tiếp xúc với thuốc.
- Không có nguyên nhân phù hợp nào khác, ví dụ như nhiễm trùng, phù phổi, tổn thương phổi do tia xạ, tiến triển của bệnh nền.
- Sự cải thiện khi ngưng thuốc nghi ngờ là thủ phạm, có hoặc không điều trị với corticosteroid, và ở một số trường hợp, bệnh tiến triển xấu khi dùng lại thuốc.
*Xét nghiệm huyết thanh học thường được dùng để loại trừ các nguyên nhân khác của ILD, vì DIILD thường là một chẩn đoán loại trừ. Rối loạn miễn dịch và bệnh mô liên kết dưới lâm sàng phải được đánh giá bằng các kháng thể nhân phổ biến: kháng thể kháng nhân ANA, yếu tố thấp RF, cyclic citrullinated peptide (CCP) antibodies, anti-synthetase antibodies, và myositis-related antibodies (creatine kinase và aldolase). Tăng eosinophil máu ngoại biên có thể có ở viêm phổi tăng eosinophil và viêm phổi tăng mẫn cảm. Tuy nhiên, các xét nghiệm này cũng không đặc hiệu và gặp ở <40% người bệnh.
*Chức năng hô hấp: quan trọng trong đánh giá DIILD, tuy nhiên, giống như CTscan, thiếu tính đặc hiệu. Giảm DLCO là đặc điểm tiền triệu của DIILD, bất thường kiểu hạn chế thường hiện diện.
*Rửa phế quản phế nang (Bronchoalveolar Lavage, BAL): tăng số lượng lymphocyte, neutrophil và eosinophil, không đặc hiệu cho DIILD vì chúng cũng xuất hiện trong các bệnh viêm hay nhiễm trùng hô hấp khác. Đảo ngược tỉ lệ CD4:CD8 có thể có, nhưng không đặc hiệu. Các dấu hiệu khác bao gồm bất thường tế bào, ví dụ như nhân phì đại và tăng sắc tố, thể lipid và đại thực bào chứa haemosiderin. Sự hiện diện phế bào type II hoạt hóa cũng được mô tả trong các ca DIILD nặng. Nhiễm trùng cơ hội rất cần trong chẩn đoán phân biệt hầu hết các ca DIILD. Ở một vài nghiên cứu, vi sinh BAL dương tính đưa đến xem lại chẩn đoán ở các ca nghi ngờ DIILD. Hiện nay, vai trò chủ đạo của BAL là hỗ trợ loại trừ nguyên nhân khác, đặc biệt là nhiễm trùng.
*Xquang: thâm nhiễm phổi một bên, hay thường hơn là hai bên trên Xquang ngực có thể là chỉ dấu đầu tiên của DIILD; tuy nhiên, 25-75% Xquang ngực bình thường ở các ca lâm sàng nghi ngờ
*HRCT: DIILD biểu hiện phổ biến nhất dưới dạng tổn thương kính mờ, có hoặc không có đông đặc, và có sự phân bố hai bên, ngoại biên, dưới đáy, thường ảnh hưởng nhiều thùy. Những thay đổi giống với viêm phổi tổ chức hóa (organising pneumonia, OP) là phổ biến nhất, theo sau bởi viêm phổi mô kẽ không đặc hiệu (non-specific interstitial pneumonia, NSIP) vàviêm phổi tăng mẫn cảm (hypersensitivity pneumonitis, HP). Các đặc điểm trên CT không đặc hiệu cho DIILD, vì nhiều nguyên nhân khác có thể gây các kiểu tổn thương này, ví dụ như nhiễm khuẩn không điển hình (đặc biệt ở người bệnh suy giảm miễn dịch), ILD do bệnh mô liên kết. Ngoài ra, các kiểu hình ảnh học của DIILD đối với một loại thuốc cũng thay đổi ( ví dụ NSIP, DAD và OP thấy ở ILD do amiodarone), và ngược lại, cùng một kiểu tổn thương có thể do nhiều loại thuốc ( ví dụ kiểu OP thấy ở nhiều tác nhân, gồm ức chế thụ thể tyrosine kinase, ức chế chốt kiểm soát miễn dịch và amiodarone)
Bảng 2.Mối liên quan giữa kiểu HRCT và các loại thuốc thường gây độc tính phổi [2]
| Kiểu HRCT | Thuốc liên quan |
| Kiểu xơ hóa
(Fibrotic pattern)
|
Nitrofurantoin (độc tính mạn tính), methotrexate, sulfalazina, rituximab, tocilizumab, bleomycin, busulfan, cyclophosphamide (độc tính mạn tính), amiodarone (form with fibrous course), tocainide, cocaine |
| Viêm phổi tổ chức hóa | Nitrofurantoin (độc tính mạn tính), methotrexate |
| Thể khảm
(Mosaic pattern) |
Nitrofurantoin (độc tính cấp tính), methotrexate, sulfalazina
|
| Kính mờ tách biệt (Isolated ground glass) | Rituximab, tocilizumab, cyclophosphamide (phản ứng cấp tính), amiodarone (giai đoạn khởi đầu), cocaine |
| Xuất huyết phế nang | Penicillamine, rituximab, cocaine |
| Phù phổi | Acetyl-salicylic acid, mitomycin |
| Tràn dịch màng phổi | Sulfonamides, methotrexate |
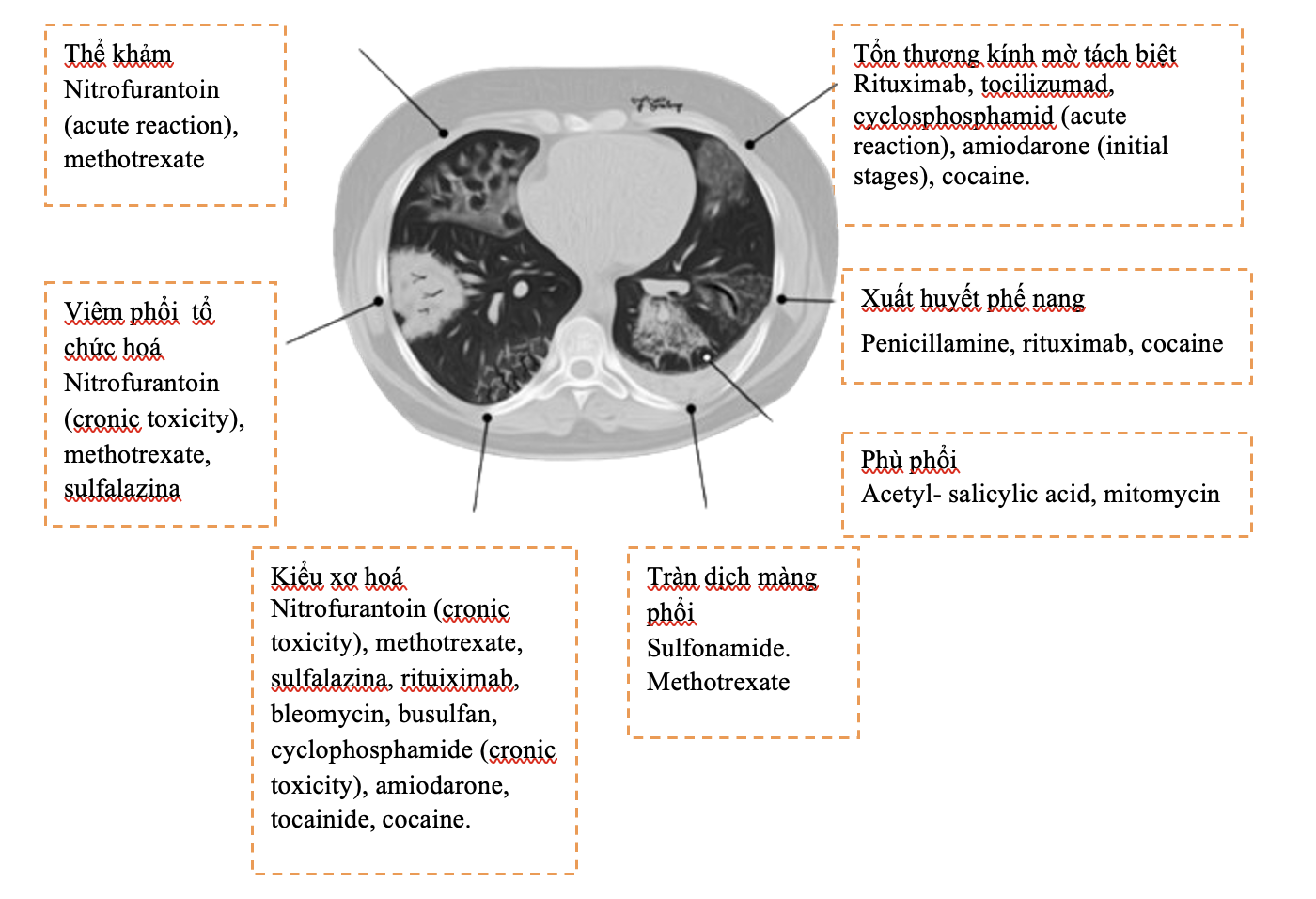
Hình 1. Mối liên quan giữa kiểu HRCT và các loại thuốc thường gây độc tính phổi [2]
*Mô bệnh học:Vai trò của sinh thiết phổi còn hạn chế ở các nghiên cứu nhỏ, hầu như tất cả các kiểu mô bệnh học được mô tả trong DIILD; tuy nhiên, không có kiểu nào đặc hiệu cho DIILD. Do đó, bằng chứng hạn chế cho việc sinh thiết thường qui trong chẩn đoán DIILD, tuy nhiên, giống BAL, có thể hữu ích ở những ca chọn lọc khi mà chẩn đoán chưa chắc chắn hoặc để loại trừ nguyên nhân khác.
- Điều trị
Bằng chứng về quản lí DIILD vẫn còn thiếu. Loại bỏ thuốc thủ phạm có lẽ là quan trọng nhất. Tuy nhiên, ở một vài nghiên cứu, thuốc vẫn được dùng thậm chí với grade 3. Nguy cơ phát triển và tiến triển DIILD phải luôn được cân bằng bởi tác động tiêu cực của việc ngưng thuốc trên tiên lượng/sống còn, và sự cân bằng mong manh này có thể thay đổi tùy theo tình trạng bệnh và hiệu quả điều trị.
Y văn không có hướng tiếp cậnnhất quán trong quyết định ngưng thuốc và không có bằng chứng mạnh mẽ cho việc dùng glucocorticoid (GC). Mặc dù liệu pháp GC đã được sử dụng trong nhiều nghiên cứu, nhưng hiện tại không có bằng chứng nào để làm cơ sở cho các khuyến nghị sử dụng GC ở DIILD. Việc sử dụng GC trong điều trị được khuyến khích ở những người bệnh bị bệnh nặng.
Nếu một loại thuốc đã được chứng minh hoặc bị nghi ngờ cao là đã gây ra DIILD, không được sử dụng lại trừ khi không có tác nhân thay thế nào khác và việc điều trị là thực sự cần thiết.
- Tiên lượng
Tiên lượng DIILD thay đổi theo loại thuốc và các nghiên cứu khác nhau. Phục hồi hoàn toàn có thể có sau giảm liều thuốc, ngưng thuốc và/hoặc dùng glucocorticoid đồng thời. Tuy nhiên, một tỉ lệ đáng kể không cải thiện, hoặc diễn tiến. Tử vong do DIILD thường do suy hô hấp, suy đa cơ quan, tiến triển của bệnh nền hoặc tác dụng phụ của điều trị Glucocorticoid (ví dụ nhiễm trùng). Trong trường hợp ung thư, tử vong thay đổi 14 đến 51.3%, trong khi những trường hợp không ung thư, tử vong dao động từ 0-41%.
*Những yếu tố dự báo tử vong:
Đặc điểm lâm sàng: biểu hiện cấp tính và nặng là chỉ dấu liên quan nhất đến tử vong. Đặc biệt, cần thông khí cơ học liên quan tử vong > 60%. Triệu chứng khởi phát nhanh, bệnh nặng hơn ngay từ đầu và giảm oxy máu lúc đầu cũng dự báo tử vong.
Kiểu hình ảnh học: với CT, tổn thương phổi rộng và kiểu đồng nhất liên quan với tử vong cao hơn ở bệnh nhaanh điều trị amiodarone. Tổn thương phế nang lan tỏa (diffuse alveolar damage, DAD) và NSIP dự báo kết cục xấu (với kiểu hình DAD, 40-83.3% tử vong). Viêm phổi mô kẽ với hình ảnh tổ ong cũng liên quan với tỉ lệ tử vong cao hơn.
Khác: với BAL, hiện diện các phế bào type II bong tróc có liên quan với tử vong.
Dự phòng
Điều quan trọng là các bác sĩ phải làm quen với các bệnh do thuốc mà người bệnh của họ có nguy cơ mắc phải, thông tin tốt hơn cho người bệnh, tránh dùng một số loại thuốc ở người bệnh dị ứng và chẩn đoán sớm hơn.
Xét nghiệm chức năng phổi nối tiếp vẫn được coi là hữu ích ở những người bệnh dùng bleomycin, ít hơn ở những người bệnh đang điều trị amiodarone hoặc methotrexate.
Tính đa hình di truyền (Genetic polymorphism) của các enzym chuyển hóa thuốc, đặc biệt là của siêu họ enzym cytochrom P450, ảnh hưởng đến hiệu quả và độ an toàn của từng loại thuốc thông qua việc thay đổi dược động học và cách phân bố thuốc. Trong tương lai, việc xác định kiểu gen đang được xem xét để xác định những người bệnh có nguy cơ cao bị phản ứng độc nặng, để hướng dẫn liều lượng thích hợp cho từng cá nhân. Cả phân tầng nguy cơ lâm sàng và di truyền có thể dẫn đến việc phòng ngừa DILD chính xác hơn trong tương lai.
Thông tin chính (key message)
- Thuốc điều trị ung thư, sau đó là thuốc điều trị thấp khớp, amiodarone và kháng sinh, là những nguyên nhân chính của DIILD.
- Hút thuốc lá và bệnh phổi có trước đó là những yếu tố nguy cơ đáng kể cho nhiều loại thuốc.
- CTscan là hình ảnh học chọn lựa trong chẩn đoán DIILD, kiểu hình DAD liên quan tử vong cao.
- Sinh thiết phổi không được chỉ định thường quy. BAL quan trọng để loại trừ nhiễm trùng.
- Độ nặng khi biểu hiện và khởi phát cấp tính là chỉ dấu liên quan nhất đến tử vong.
Tài liệu tham khảo
- 01 Skeoch, S., Weatherley, N., Swift, A. J., Oldroyd, A., Johns, C., Hayton, C., ... & Chaudhuri, N. (2018). Drug-induced interstitial lung disease: a systematic review. Journal of clinical medicine, 7(10), 356.
- 02 Distefano, G., Fanzone, L., Palermo, M., Tiralongo, F., Cosentino, S., Inì, C., ... & Basile, A. (2020). HRCT patterns of drug-induced interstitial lung diseases: a review. Diagnostics, 10(4), 244.
- 03 Eaden, J. A., Skeoch, S., Waterton, J. C., Chaudhuri, N., & Bianchi, S. M. (2020). How consistently do physicians diagnose and manage drug-induced interstitial lung disease? Two surveys of European ILD specialist physicians. ERJ open research, 6(1).
- 04 Ratwani, A., Gupta, B., Stephenson, B. W., Mani, H., & Brown, A. W. (2019). The spectrum of drug-induced interstitial lung disease. Current Pulmonology Reports, 8(4), 139-150.
- 05 Schwaiblmair, M., Behr, W., Haeckel, T., Märkl, B., Foerg, W., & Berghaus, T. (2012). Drug induced interstitial lung disease. The open respiratory medicine journal, 6, 63.
- 06 Dulohery, Megan M., Fabien Maldonado, and Andrew H. Limper (2016). Drug-induced pulmonary disease. In: V. Courtney Broaddus, Robert J. Mason, Joel D. Ernst, Talmadge E. King, Stephen C. Lazarus, John F. Murray, Jay A. Nadel, Arthur S. Slutsky, Michael B. Gotway. Murray and Nadel's Textbook of Respiratory Medicine, V2, 6thed, pp.1275-1294. WB Saunders,
- 07 Müller, N. L., White, D. A., Jiang, H., & Gemma, A. (2004). Diagnosis and management of drug-associated interstitial lung disease. British Journal of Cancer, 91(2), S24-S30.
- 08 Jessurun, N. T., Drent, M., van Puijenbroek, E. P., Bekers, O., Wijnen, P. A., & Bast, A. (2019). Drug-induced interstitial lung disease: role of pharmacogenetics in predicting cytotoxic mechanisms and risks of side effects. Current Opinion in Pulmonary Medicine, 25(5), 468-477.
- 09 Cancer Therapy Evaluation Program DoCTaDNCINIoH. Common Terminology Criteria for Adverse Events [Internet]. Version 5.0. 27-11-2017. [(accessed on 13 October 2018)]; Available online: https://ctep.cancer.gov/
Bệnh phổi mô kẽ do thuốc (Drug-induced interstitial lung disease, DIILD) xảy ra khi tiếp xúc với một thuốc gây viêm và cuối cùng gây xơ hóa mô kẽ phổi.
Bệnh phổi mô kẽ do thuốc là một chủ đề rất thách thức đối với cả lâm sàng và lí thuyết. Một số nhóm thuốc nhất định có xu hướng gây ra các kiểu tổn thương phổi giống và chồng chéo nhau.
Hơn 350 loại thuốc được biết gây bệnh phổi do thuốc, tần suất chính xác vẫn chưa rõ. Số lượng thuốc gây bệnh phổi chắc chắn sẽ liên tục tăng lên khi càng nhiều thuốc mới được phát triển.
Xuất độ DIILD thay đổi giữa 4.1 – 12.4 ca/triệu người/năm. DIILD chiếm 3-5% các ca bệnh phổi mô kẽ (interstitial lung disease, ILD) lưu hành.
Thuốc điều trị ung thư, sau đó là thuốc điều trị thấp khớp, amiodarone và kháng sinh, là những nguyên nhân chính của DIILD
- Nguyên nhân/ yếu tố nguy cơ
Các thuốc gây bệnh thường gặp
- Thuốc điều trị ung thư
Thuốc ung thư là nguyên nhân hàng đầu của DIILD trong hầu hết các nghiên cứu, chiếm 23–51% các trường hợp, tiếp theo là các thuốc chống thấp khớp thay đổi diễn tiến bệnh (DMARDs) (6–72%), kháng sinh (6–26%), thuốc chống viêm non-steroid (NSAIDs) (0–23%), thuốc điều trị tâm thần (0–9%) và thuốc chống loạn nhịp tim (0–9%).
Bleomycin từng chủ yếu được dùng điều trị lymphoma Hodgkin và u tế bào mầm, gây tổn thương phổi thông qua tác động trung gian miễn dịch và tác động gây độc trực tiếp. Nguy cơ được báo cáo là 6.8-21%, tỉ lệ tử vong liên quan lên đến 48%.
- Thuốc điều trị thấp khớp
Trong thấp học, phân tích DIILD bị cản trở bởi sự lưu hành sẵn có của ILD, đặc biệt là ở người bệnh viêm khớp dạng thấp. Hơn nữa, nhiều thuốc chống thấp thay đổi diễn tiến bệnh (disease-modifying anti-rheumatic drugs, DMARDs) có tác dụng ức chế miễn dịch và liên quan với sự tăng nguy cơ nhiễm trùng cơ hội, đưa đến thách thức trong chẩn đoán phân biệt các triệu chứng hô hấp xấu đi.
Methotrexate (MTX) là thuốc chính trong thấp khớp học và cho điều trị lymphom và sarcom. Xuất độ của DIILD ở người bệnh viêm khớp dạng thấp với liều thấp MTX được báo cáo là 0.3-2.1%. DIILD do MTX có thời gian và tốc độ khởi phát thay đổi và dường như không phụ thuộc liều. Trong một nghiên cứu, 48% các ca phát triển trong vòng 32 tuần khởi trị.
- Kháng sinh
Nitrofurantoin thường được dùng cho điều trị và dự phòng nhiễm trùng tiểu. DIILD chiếm 16-48% các biến cố bất lợi liên quan nitrofurantoin được báo cáo.
Ở một nghiên cứu 447 ca DIILD liên quan nitrofurantoin ở Thụy Điển, hầu hết 90% là phản ứng cấp tính. Tỉ lệ nhập viện là 75%, tử vong 0.5% và 8% lần lượt cho người bệnh phản ứng phổi cấp và viêm phổi mô kẽ mạn tính.
- Thuốc chống loạn nhịp
Amiodarone là một trong những nguyên nhân phổ biến nhất gây DIILD, xuất độ được báo cáo 1.2-8.8% và tử vong 3-37%. Liều tích lũy là một yếu tố nguy cơ quan trọng cho DIILD do amiodarone, sự kết hợp liều cao và dùng trong thời gian dài liên quan mạnh với DIILD hơn từng yếu tố riêng lẻ.
Yếu tố nguy cơ của DIILD
Các yếu tố nguy cơ cho phát triển DIILD thay đổi dựa theo bệnh, thuốc và dân số. Các yếu tố nguy cơ nhất định có đặc điểm ưu thế qua từng thuốc
Tuổi: tuổi cao được xem là yếu tố nguy cơ đáng kể cho DIILD khi điều trị với bleomycin, gemcitabine, thuốc nhắm thụ thể EGFR, leflunomide, MTX, amiodarone và nitrofurantoin
Bệnh phổi trước đó: ILD hay xơ phổi vô căn có trước là yếu tố nguy cơ độc lập đối với DIILD
Hút thuốc lá: người hút thuốc lá có nguy cơ cao DIILD khi điều trị với gemcitabine, thuốc nhắm thụ thể EGFR và MTX
Liều thuốc: mối quan hệ phụ thuộc liều rõ ràng được công nhận với bleomycin, amiodarone và nitrofurantoin
Đặc điểm bệnh nền: trong ung thư, tình trạng hoạt động (performance status) kém và giai đoạn bệnh tiến triển hay di căn là yếu tố nguy cơ độc lập với DIILD
Giới tính: giới nam được báo cáo là yếu tố nguy cơ cho DIILD ở một số nghiên cứu điều trị với ức chế EFGR, pemetrexed, methotrexate và amiodarone
Các điều trị khác: đối với gemcitabine, hóa trị trước đó mang đến nguy cơ tương đối DIILD 1.45 lần. Xạ trị lồng ngực trước đó cũng tăng nguy cơ DIILD ở người bệnh ung thư phổi.
Các yếu tố nguy cơ khác: các yếu tố nguy cơ tiềm tàng DIILD gồm tính mẫn cảm di truyền, uống nhiều rượu, suy thận, đái tháo đường.
4 cơ chế của thuốc gây tổn thương phổi
Tổn thương do oxi hóa, ví dụ như uống nitrofurantoin kéo dài.
Tác động độc tế bào trực tiếp (và những tác động này có thể bị làm trầm trọng thêm bởi tổn thương do oxy hóa).
Lắng đọng phospholipids trong tế bào, ví dụ như amiodarone.
Tổn thương qua trung gian miễn dịch thông qua lupus ban đỏ hệ thống gây ra do thuốc.
Bảng 1. Phân độ nặng được đồng thuận quốc tế dùng trong các thử nghiệm lâm sàng [9]
| Mức độ | Biểu hiện |
| Grade 1 (nhẹ) | Không triệu chứng, chỉ có biểu hiện trên hình ảnh học |
| Grade 2 (trung bình) | Có triệu chứng, không ảnh hưởng đến hoạt động hàng ngày |
| Grade 3 (nặng) | Có triệu chứng, ảnh hưởng hoạt động hàng ngày hoặc cần oxy |
| Grade 4 (đe dọa tính mạng hay tàn phế) | Đe dọa tính mạng hay cần thông khí hỗ trợ |
| Grade 5 (tử vong) |
Các triệu chứng DIILD không đặc hiệu, bao gồm ho, sốt, khó thở, ho máu, khò khè và đau ngực kiểu màng phổi. Biểu hiện lâm sàng thường gây nhầm lẫn với nhiễm trùng hô hấp và thường được điều trị ban đầu với kháng sinh. DIILD thường được xem xét khi không có cải thiện lâm sàng đáng kể với điều trị kháng sinh kinh nghiệm.
Thời gian khởi phát triệu chứng thì phần lớn phụ thuộc vào thuốc thủ phạm. Một số thuốc gây triệu chứng trong vòng vài ngày, trong khi số khác ví dụ như thuốc hóa trị gây độc tế bào cần đến vài tuần đến vài tháng, thậm chí hàng năm do phụ thuộc sự tích lũy liều.
Khám lâm sàng không đặc hiệu, dấu hiệu thường gặp gồm ran phổi “Velcro” khô, thi thoảng có ngón tay dùi trống. suy chức năng thất phải có thể có với tĩnh mạch cổ nổi và phù chân. Dấu hiệu của rối loạn tự miễn nên được đánh gia khi khám lâm sàng vì bệnh mô liên kết là một chẩn đoán phân biệt.
DIILD được chẩn đoán khi
- Các dấu hiệu hình ảnh, sinh lí, lâm sàng phù hợp với ILD.
- Mối quan hệ thời gian giữa khởi phát triệu chứng và tiếp xúc với thuốc.
- Không có nguyên nhân phù hợp nào khác, ví dụ như nhiễm trùng, phù phổi, tổn thương phổi do tia xạ, tiến triển của bệnh nền.
- Sự cải thiện khi ngưng thuốc nghi ngờ là thủ phạm, có hoặc không điều trị với corticosteroid, và ở một số trường hợp, bệnh tiến triển xấu khi dùng lại thuốc.
*Xét nghiệm huyết thanh học thường được dùng để loại trừ các nguyên nhân khác của ILD, vì DIILD thường là một chẩn đoán loại trừ. Rối loạn miễn dịch và bệnh mô liên kết dưới lâm sàng phải được đánh giá bằng các kháng thể nhân phổ biến: kháng thể kháng nhân ANA, yếu tố thấp RF, cyclic citrullinated peptide (CCP) antibodies, anti-synthetase antibodies, và myositis-related antibodies (creatine kinase và aldolase). Tăng eosinophil máu ngoại biên có thể có ở viêm phổi tăng eosinophil và viêm phổi tăng mẫn cảm. Tuy nhiên, các xét nghiệm này cũng không đặc hiệu và gặp ở <40% người bệnh.
*Chức năng hô hấp: quan trọng trong đánh giá DIILD, tuy nhiên, giống như CTscan, thiếu tính đặc hiệu. Giảm DLCO là đặc điểm tiền triệu của DIILD, bất thường kiểu hạn chế thường hiện diện.
*Rửa phế quản phế nang (Bronchoalveolar Lavage, BAL): tăng số lượng lymphocyte, neutrophil và eosinophil, không đặc hiệu cho DIILD vì chúng cũng xuất hiện trong các bệnh viêm hay nhiễm trùng hô hấp khác. Đảo ngược tỉ lệ CD4:CD8 có thể có, nhưng không đặc hiệu. Các dấu hiệu khác bao gồm bất thường tế bào, ví dụ như nhân phì đại và tăng sắc tố, thể lipid và đại thực bào chứa haemosiderin. Sự hiện diện phế bào type II hoạt hóa cũng được mô tả trong các ca DIILD nặng. Nhiễm trùng cơ hội rất cần trong chẩn đoán phân biệt hầu hết các ca DIILD. Ở một vài nghiên cứu, vi sinh BAL dương tính đưa đến xem lại chẩn đoán ở các ca nghi ngờ DIILD. Hiện nay, vai trò chủ đạo của BAL là hỗ trợ loại trừ nguyên nhân khác, đặc biệt là nhiễm trùng.
*Xquang: thâm nhiễm phổi một bên, hay thường hơn là hai bên trên Xquang ngực có thể là chỉ dấu đầu tiên của DIILD; tuy nhiên, 25-75% Xquang ngực bình thường ở các ca lâm sàng nghi ngờ
*HRCT: DIILD biểu hiện phổ biến nhất dưới dạng tổn thương kính mờ, có hoặc không có đông đặc, và có sự phân bố hai bên, ngoại biên, dưới đáy, thường ảnh hưởng nhiều thùy. Những thay đổi giống với viêm phổi tổ chức hóa (organising pneumonia, OP) là phổ biến nhất, theo sau bởi viêm phổi mô kẽ không đặc hiệu (non-specific interstitial pneumonia, NSIP) vàviêm phổi tăng mẫn cảm (hypersensitivity pneumonitis, HP). Các đặc điểm trên CT không đặc hiệu cho DIILD, vì nhiều nguyên nhân khác có thể gây các kiểu tổn thương này, ví dụ như nhiễm khuẩn không điển hình (đặc biệt ở người bệnh suy giảm miễn dịch), ILD do bệnh mô liên kết. Ngoài ra, các kiểu hình ảnh học của DIILD đối với một loại thuốc cũng thay đổi ( ví dụ NSIP, DAD và OP thấy ở ILD do amiodarone), và ngược lại, cùng một kiểu tổn thương có thể do nhiều loại thuốc ( ví dụ kiểu OP thấy ở nhiều tác nhân, gồm ức chế thụ thể tyrosine kinase, ức chế chốt kiểm soát miễn dịch và amiodarone)
Bảng 2.Mối liên quan giữa kiểu HRCT và các loại thuốc thường gây độc tính phổi [2]
| Kiểu HRCT | Thuốc liên quan |
| Kiểu xơ hóa
(Fibrotic pattern)
|
Nitrofurantoin (độc tính mạn tính), methotrexate, sulfalazina, rituximab, tocilizumab, bleomycin, busulfan, cyclophosphamide (độc tính mạn tính), amiodarone (form with fibrous course), tocainide, cocaine |
| Viêm phổi tổ chức hóa | Nitrofurantoin (độc tính mạn tính), methotrexate |
| Thể khảm
(Mosaic pattern) |
Nitrofurantoin (độc tính cấp tính), methotrexate, sulfalazina
|
| Kính mờ tách biệt (Isolated ground glass) | Rituximab, tocilizumab, cyclophosphamide (phản ứng cấp tính), amiodarone (giai đoạn khởi đầu), cocaine |
| Xuất huyết phế nang | Penicillamine, rituximab, cocaine |
| Phù phổi | Acetyl-salicylic acid, mitomycin |
| Tràn dịch màng phổi | Sulfonamides, methotrexate |

Hình 1. Mối liên quan giữa kiểu HRCT và các loại thuốc thường gây độc tính phổi [2]
*Mô bệnh học:Vai trò của sinh thiết phổi còn hạn chế ở các nghiên cứu nhỏ, hầu như tất cả các kiểu mô bệnh học được mô tả trong DIILD; tuy nhiên, không có kiểu nào đặc hiệu cho DIILD. Do đó, bằng chứng hạn chế cho việc sinh thiết thường qui trong chẩn đoán DIILD, tuy nhiên, giống BAL, có thể hữu ích ở những ca chọn lọc khi mà chẩn đoán chưa chắc chắn hoặc để loại trừ nguyên nhân khác.
- Điều trị
Bằng chứng về quản lí DIILD vẫn còn thiếu. Loại bỏ thuốc thủ phạm có lẽ là quan trọng nhất. Tuy nhiên, ở một vài nghiên cứu, thuốc vẫn được dùng thậm chí với grade 3. Nguy cơ phát triển và tiến triển DIILD phải luôn được cân bằng bởi tác động tiêu cực của việc ngưng thuốc trên tiên lượng/sống còn, và sự cân bằng mong manh này có thể thay đổi tùy theo tình trạng bệnh và hiệu quả điều trị.
Y văn không có hướng tiếp cậnnhất quán trong quyết định ngưng thuốc và không có bằng chứng mạnh mẽ cho việc dùng glucocorticoid (GC). Mặc dù liệu pháp GC đã được sử dụng trong nhiều nghiên cứu, nhưng hiện tại không có bằng chứng nào để làm cơ sở cho các khuyến nghị sử dụng GC ở DIILD. Việc sử dụng GC trong điều trị được khuyến khích ở những người bệnh bị bệnh nặng.
Nếu một loại thuốc đã được chứng minh hoặc bị nghi ngờ cao là đã gây ra DIILD, không được sử dụng lại trừ khi không có tác nhân thay thế nào khác và việc điều trị là thực sự cần thiết.
- Tiên lượng
Tiên lượng DIILD thay đổi theo loại thuốc và các nghiên cứu khác nhau. Phục hồi hoàn toàn có thể có sau giảm liều thuốc, ngưng thuốc và/hoặc dùng glucocorticoid đồng thời. Tuy nhiên, một tỉ lệ đáng kể không cải thiện, hoặc diễn tiến. Tử vong do DIILD thường do suy hô hấp, suy đa cơ quan, tiến triển của bệnh nền hoặc tác dụng phụ của điều trị Glucocorticoid (ví dụ nhiễm trùng). Trong trường hợp ung thư, tử vong thay đổi 14 đến 51.3%, trong khi những trường hợp không ung thư, tử vong dao động từ 0-41%.
*Những yếu tố dự báo tử vong:
Đặc điểm lâm sàng: biểu hiện cấp tính và nặng là chỉ dấu liên quan nhất đến tử vong. Đặc biệt, cần thông khí cơ học liên quan tử vong > 60%. Triệu chứng khởi phát nhanh, bệnh nặng hơn ngay từ đầu và giảm oxy máu lúc đầu cũng dự báo tử vong.
Kiểu hình ảnh học: với CT, tổn thương phổi rộng và kiểu đồng nhất liên quan với tử vong cao hơn ở bệnh nhaanh điều trị amiodarone. Tổn thương phế nang lan tỏa (diffuse alveolar damage, DAD) và NSIP dự báo kết cục xấu (với kiểu hình DAD, 40-83.3% tử vong). Viêm phổi mô kẽ với hình ảnh tổ ong cũng liên quan với tỉ lệ tử vong cao hơn.
Khác: với BAL, hiện diện các phế bào type II bong tróc có liên quan với tử vong.
Điều quan trọng là các bác sĩ phải làm quen với các bệnh do thuốc mà người bệnh của họ có nguy cơ mắc phải, thông tin tốt hơn cho người bệnh, tránh dùng một số loại thuốc ở người bệnh dị ứng và chẩn đoán sớm hơn.
Xét nghiệm chức năng phổi nối tiếp vẫn được coi là hữu ích ở những người bệnh dùng bleomycin, ít hơn ở những người bệnh đang điều trị amiodarone hoặc methotrexate.
Tính đa hình di truyền (Genetic polymorphism) của các enzym chuyển hóa thuốc, đặc biệt là của siêu họ enzym cytochrom P450, ảnh hưởng đến hiệu quả và độ an toàn của từng loại thuốc thông qua việc thay đổi dược động học và cách phân bố thuốc. Trong tương lai, việc xác định kiểu gen đang được xem xét để xác định những người bệnh có nguy cơ cao bị phản ứng độc nặng, để hướng dẫn liều lượng thích hợp cho từng cá nhân. Cả phân tầng nguy cơ lâm sàng và di truyền có thể dẫn đến việc phòng ngừa DILD chính xác hơn trong tương lai.
- Thuốc điều trị ung thư, sau đó là thuốc điều trị thấp khớp, amiodarone và kháng sinh, là những nguyên nhân chính của DIILD.
- Hút thuốc lá và bệnh phổi có trước đó là những yếu tố nguy cơ đáng kể cho nhiều loại thuốc.
- CTscan là hình ảnh học chọn lựa trong chẩn đoán DIILD, kiểu hình DAD liên quan tử vong cao.
- Sinh thiết phổi không được chỉ định thường quy. BAL quan trọng để loại trừ nhiễm trùng.
- Độ nặng khi biểu hiện và khởi phát cấp tính là chỉ dấu liên quan nhất đến tử vong.
- 01 Skeoch, S., Weatherley, N., Swift, A. J., Oldroyd, A., Johns, C., Hayton, C., ... & Chaudhuri, N. (2018). Drug-induced interstitial lung disease: a systematic review. Journal of clinical medicine, 7(10), 356.
- 02 Distefano, G., Fanzone, L., Palermo, M., Tiralongo, F., Cosentino, S., Inì, C., ... & Basile, A. (2020). HRCT patterns of drug-induced interstitial lung diseases: a review. Diagnostics, 10(4), 244.
- 03 Eaden, J. A., Skeoch, S., Waterton, J. C., Chaudhuri, N., & Bianchi, S. M. (2020). How consistently do physicians diagnose and manage drug-induced interstitial lung disease? Two surveys of European ILD specialist physicians. ERJ open research, 6(1).
- 04 Ratwani, A., Gupta, B., Stephenson, B. W., Mani, H., & Brown, A. W. (2019). The spectrum of drug-induced interstitial lung disease. Current Pulmonology Reports, 8(4), 139-150.
- 05 Schwaiblmair, M., Behr, W., Haeckel, T., Märkl, B., Foerg, W., & Berghaus, T. (2012). Drug induced interstitial lung disease. The open respiratory medicine journal, 6, 63.
- 06 Dulohery, Megan M., Fabien Maldonado, and Andrew H. Limper (2016). Drug-induced pulmonary disease. In: V. Courtney Broaddus, Robert J. Mason, Joel D. Ernst, Talmadge E. King, Stephen C. Lazarus, John F. Murray, Jay A. Nadel, Arthur S. Slutsky, Michael B. Gotway. Murray and Nadel's Textbook of Respiratory Medicine, V2, 6thed, pp.1275-1294. WB Saunders,
- 07 Müller, N. L., White, D. A., Jiang, H., & Gemma, A. (2004). Diagnosis and management of drug-associated interstitial lung disease. British Journal of Cancer, 91(2), S24-S30.
- 08 Jessurun, N. T., Drent, M., van Puijenbroek, E. P., Bekers, O., Wijnen, P. A., & Bast, A. (2019). Drug-induced interstitial lung disease: role of pharmacogenetics in predicting cytotoxic mechanisms and risks of side effects. Current Opinion in Pulmonary Medicine, 25(5), 468-477.
- 09 Cancer Therapy Evaluation Program DoCTaDNCINIoH. Common Terminology Criteria for Adverse Events [Internet]. Version 5.0. 27-11-2017. [(accessed on 13 October 2018)]; Available online: https://ctep.cancer.gov/