Bệnh học
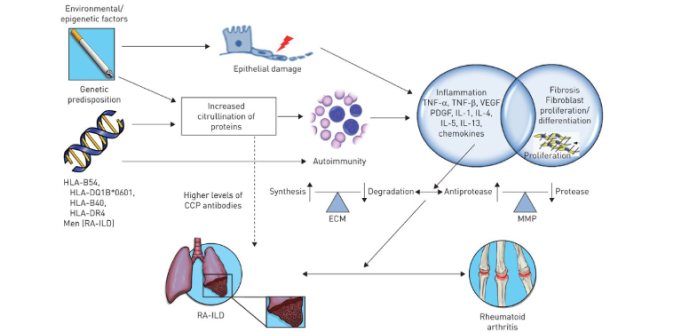
Cơ chế xơ phổi trong BPMK/VKDT vẫn chưa được hiểu rõ. Khuynh hướng di truyền và các yếu tố ngoài di truyền được cho là có vai trò nhất định. Một số bệnh nhân bị viêm khớp dạng thấp có thể có khuynh hướng di truyền với BPMK. HLA-B54, HLA-DQ1B * 0601, HLA-B40, HLA-DR4 và chất ức chế protease mã hóa vị trí α-1 có liên quan đến việc tăng nguy cơ BPMK trong VKDT, trong khi một số quyết định kháng nguyên (HLA- DRB1) có liên quan đến sự phát triển của bệnh VKDT nhưng giảm tỷ lệ BPMK/VKDT. Giới nam và lớn tuổi là những yếu tố nguy cơ của BPMK/VKDT. Cả hai yếu tố di truyền và hút thuốc đều có liên quan đến sự gia tăng sự citruline hóa của protein trong phổi, cho phép tiếp xúc với các quyết định kháng nguyên mới và phản ứng tự miễn dịch.

Hút thuốc lá cũng là một yếu tố nguy cơ của riêng bệnh viêm khớp dạng thấp và dẫn đến tổn thương lặp đi lặp lại đối với biểu mô phế nang và những thay đổi trong cytokine. Hút thuốc lá thúc đẩy sự tạo thành các protein ở phổi, do đó dẫn đến sự phát triển của các kháng thể kháng CCP. Điều này đặc biệt xảy ra đối với những người có chung HLA-DRB1.
Trong BPMK, phản ứng viêm kích hoạt các cytokine, chemokine và các yếu tố tăng trưởng, chẳng hạn như yếu tố hoại tử khối u (TNF: tumor necrosis factor), yếu tố tăng trưởng nội mô mạch máu (VEGF: vascular endothelial growth factor), yếu tố tăng trưởng có nguồn gốc từ tiểu cầu (PDGF: platelet derived growth factor) và interleukin (IL). Những điều này góp phần vào sự biệt hóa và tăng sinh của nguyên bào sợi, tăng tổng hợp và lắng đọng chất nền ngoại bào và tăng hoạt tính của chất nền metalloproteinase (MMP) dẫn đến BPMK. Nguyên bào sợi trong bao hoạt dịch có vai trò tương tự trong cơ chế bệnh sinh của các biểu hiện khớp của VKDT.
Triệu chứng
Khó thở khi gắng sức, ho, đau ngực, mệt mỏi
Khám lâm sàng có thể thấy ngón tay dùi trống (15%), nghe phổi có ran nổ Velcro hai bên ở BN BPMK có xơ hóa (72-100%)
Chẩn đoán
Cần kết hợp lâm sàng và các xét nghiệm cận lâm sàng
I. Chức năng hô hấp
Khả năng khuếch tán khí qua màng phế nang mao mạch (DLCO) có giảm hoặc không.
Giảm oxy máu.
Hội chứng tắc nghẽn có thể có và được thấy ở những bệnh nhân có biểu hiện liên quan đến đường thở, ví dụ viêm phế quản tắc nghẽn.
II. Hình ảnh học
X quang lồng ngực là phương pháp không nhạy để phát hiện BPMK/VKDT. Có tới 64% bệnh nhân BPMK trên HRCT sẽ không có các thay đổi kẽ rõ ràng trên phim chụp X-quang lồng ngực [6]
Ở những bệnh nhân đã biết VKDT, và trong trường hợp lâm sàng không có nghi ngờ nhiễm trùng và/hoặc các biến chứng hô hấp khác thì HRCT có thể được sử dụng để chẩn đoán BPMK. Nhiều dạng khác nhau được thấy trên HRCT ở bệnh VKDT, trong đó phổ biến nhất là viêm phổi kẽ thông thường (UIP) chiếm 40–62% các trường hợp. Đây là một sự khác biệt đáng chú ý so với các bệnh mô liên kết khác, trong đó dạng viêm phổi mô kẽ không đặc hiệu (NSIP) thường thấy nhất. Hình ảnh UIP trong HRCT cho thấy tổn thương dưới màng phổi, ưu thế ở đáy phổi, với hình ảnh tổ ong, và giãn phế quản co kéo, tương đối ít tổn thương kính mờ (hình 2). NSIP là dạng phổ biến thứ hai, xảy ra ở ∼11–32% bệnh nhân. NSIP được đặc trưng bởi tổn thương dạng kính mờ và không có tổ ong (hình 3). Các dạng khác ít gặp hơn bao gồm viêm phổi tổ chức hóa, tổn thương phế nang lan tỏa (DAD), viêm phổi kẽ tế bào lympho (LIP) và viêm phổi mô kẽ bong vảy (DIP). Xơ phổi kết hợp và khí thũng (CPFE) cũng đã được phát hiện trên HRCT ở bệnh nhân VKDT. [4]
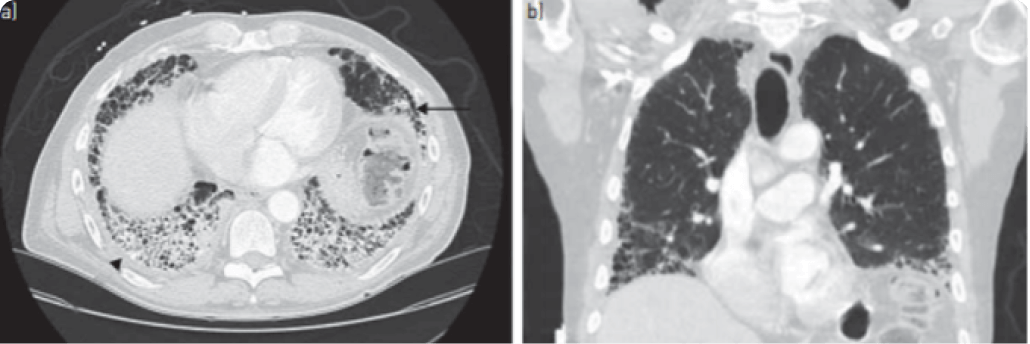
Hình 2: hình cắt ngang a) và cắt dọc b) ở BN BPMK/VKDT tổn thương dưới màng phổi, ưu thế ở đáy phổi, với hình ảnh tổ ong (mũi tên), và giãn phế quản co kéo, dày màng phổi
(đầu mũi tên)
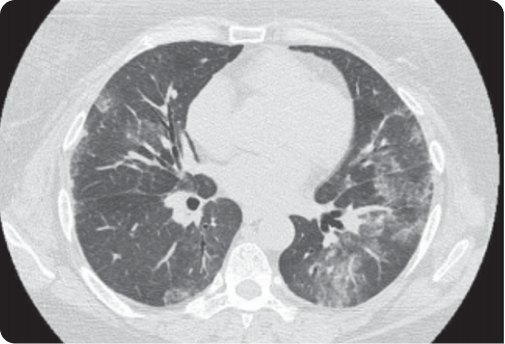
Hình 3: Hình ảnh HRCT ở BN BPMK/VKDT với tổn thương kính mờ ở dưới màng phổi
III. Nội soi phế quản
Rửa phế quản phế nang trong nội soi phế quản để loại trừ nhiễm trùng và đánh giá đặc điểm tế bào viêm trong phổi. Tuy nhiên, các báo cáo về số lượng tế bào còn mơ hồ. Mặc dù số lượng tế bào lympho tăng trong dịch rửa phế quản phế nang, nhưng kết quả không nhất quán.
IV. Mô bệnh học
Là tiêu chuẩn vàng chẩn đoán BPMK/VKDT
Có thể thấy sự khác biệt nhỏ về mô bệnh học giữa UIP liên quan đến VKDT và UIP-xơ phổi vô căn; trong viêm khớp dạng thấp, UIP thường có ít nguyên bào sợi hơn và số lượng trung tâm mầm nhiều hơn. Điều này có thể không phải là duy nhất đối với UIP, vì số lượng tế bào T CD4 cao hơn đáng kể đã được mô tả trong các mẫu mô của cả UIP và NSIP khi so sánh với bệnh viêm phổi mô kẽ vô căn đơn thuần. Việc phân biệt giữa các dạng ILD có thể hữu ích trong việc tiên lượng vì bệnh nhân UIP hoặc DAD có tỷ lệ tử vong trong 5 năm cao hơn so với những bệnh nhân có các dạng như NSIP hoặc viêm phổi tổ chức hóa.
Chẩn đoán phân biệt
- Bệnh phổi do thuốc.
- Nhiễm trùng.
- Giãn phế quản.
- COPD.
- Suy tim sung huyết.
- Tràn dịch màng phổi.
- Bệnh ác tính (ung thư phổi, ung thư hạch).
- Đợt cấp trong BPMK/VKDT.
- Các bệnh nhu mô phổi liên quan đến hút thuốc lá.
- Nốt thấp.

Điều trị
Các chiến lược điều trị mới cho VKDT đã làm giảm hoạt động của bệnh, nhưng việc điều trị tối ưu sự liên quan đến phổi vẫn còn nan giải. Cho đến nay, không có thử nghiệm ngẫu nhiên có đối chứng nào trong BPMK/VKDT được thực hiện. Corticosteroid, azathioprine và mycophenolate là những lựa chọn điều trị được sử dụng rộng rãi nhất, với rituximab hoặc chất ức chế TNF-alpha là những lựa chọn thay thế ở những bệnh nhân bị bệnh khó chữa. Đáp ứng điều trị thường tốt hơn ở BPMK/VKDT có mô hình viêm. Bệnh xơ hóa, đặc biệt là VKDT-UIP, có xu hướng ít đáp ứng hơn và diễn biến của bệnh tương tự như xơ phổi vô căn (IPF) [6].
Chờ đợi hoặc bắt đầu điều trị là một thách thức trong BPMK/VKDT. Điều trị chủ yếu bắt đầu ở bệnh có ý nghĩa lâm sàng khi có bằng chứng về sự tiến triển của bệnh. Đánh giá triệu chứng, chức năng hô hấp, bao gồm đo DLCO là một phần của quá trình theo dõi. Theo dõi HRCT nên được hướng dẫn bởi các triệu chứng và suy giảm chức năng phổi. Khoảng thời gian theo dõi tối ưu không được biết và sẽ phụ thuộc vào diễn biến bệnh và phương pháp điều trị. Theo dõi 3–6 tháng một lần khi bệnh ổn định thường được áp dụng trong thực hành lâm sàng.
Phương pháp điều trị cho bệnh nhân BPMK/VKDT còn phức tạp do một số vấn đề chưa được giải quyết. Thứ nhất, cả thuốc DMARD và thuốc sinh học đều có liên quan đến sự phát triển của độc tính phổi liên quan đến thuốc với dữ liệu mâu thuẫn nhau; thứ hai, không có bằng chứng cho thấy việc điều trị VKDT có thể có hiệu quả đối với phổi. Ngược lại, các loại thuốc ức chế miễn dịch được sử dụng trong các bệnh mô liên kết (CTD) hoặc thuốc chống xơ hóa được chấp thuận cho bệnh xơ phổi vô căn (IPF) không có hiệu quả đối với bệnh viêm khớp. [7]
Điều trị BPMK/VKDT không giống như điều trị VKDT có bệnh đồng mắc là BPMK. [7]
I. Corticosteroid
Tác dụng của corticosteroid trên bệnh nhân UIP vẫn chưa rõ ràng.
II. Cyclophosphamide và Mycophenolate Mofetil
Không có thử nghiệm lâm sàng đối chứng nào đối với Cyclophosphamide (CYC) trong BPMK/VKDT, nhưng nó được sử dụng trong thực hành lâm sàng mặc dù dữ liệu về hiệu quả hạn chế [8], đặc biệt trong trường hợp ILD tiến triển nhanh.
Vì CYC cho thấy ít lợi ích đối với BPMK/VKDT, nó thường được kết hợp với corticosteroid hoặc các chất ức chế miễn dịch khác.
Mycophenolate mofetil (MMF) được coi là sự thay thế chính cho CYC như một tác nhân đầu tay hoặc một liệu pháp duy trì có thể có trong CTD-ILD, với tỷ lệ tác dụng phụ thấp hơn CYC. Năm 2016, một nghiên cứu hồi cứu từ Vương quốc Anh cho thấy khả năng sống tốt hơn ở những bệnh nhân được điều trị bằng MMF so với azathioprine (AZA). Nguy cơ tử vong tương đối vì bất kỳ nguyên nhân nào đều tăng đối với bệnh nhân dùng prednisone, không thay đổi đối với AZA và giảm đối với MMF. Các tác giả đề xuất MMF tốt hơn là CS hoặc AZA để điều trị BPMK/VKDT [9].
III. Thuốc sinh học
Rituximab (RTX), một kháng thể kháng CD20 làm suy giảm tế bào B, đã được sử dụng cho 700 BN bị VKDT; 56 BN bị BPMK/VKDT trước khi điều trị rituximab. 68% những bệnh nhân này đã cải thiện hoặc có chức năng phổi ổn định sau rituximab.
Rituximab an toàn và chỉ có ba bệnh nhân (0,4%) phát triển BPMK sau khi điều trị bằng RTX, điều này có thể chỉ ra tác dụng bảo vệ của rituximab [10]. Một phản ứng tương tự đã được thấy trong loạt trường hợp nhỏ hơn. Do đó, rituximab có thể hữu ích ở những bệnh nhân mắc BPMK/Bệnh mô liên kết.
Việc sử dụng liệu pháp ức chế TNF-alpha trong BPMK/VKDT cũng giới hạn trong những báo cáo loạt ca, cho thấy có sự ổn định BPMK.
IV. Thuốc chống xơ
BPMK/VKDT có một số điểm tương đồng với xơ phổi vô căn (IPF), đặc biệt là ở những bệnh nhân có mô hình UIP.
Thử nghiệm INBUILD đã đánh giá hiệu quả và tính an toàn của nintedanib ở những bệnh nhân được chẩn đoán BPMK không phải xơ phổi vô căn, bao gồm cả VKDT [11]. Hơn nữa, một số thử nghiệm đã được lên kế hoạch hoặc đang tiến hành để đánh giá hiệu quả và tính an toàn của các thuốc chống xơ hóa trong điều trị BPMK xơ hóa ngoài IPF, bao gồm cả những bệnh nhân bị VKDT.
1. Pirfenidone [7]
Ở Châu Âu, pirfenidone được chấp thuận để điều trị IPF.
Pirfenidone làm giảm nồng độ IL6 và TNF-alpha, cả hai cytokine liên quan đến sự hoạt hóa của đại thực bào và với vai trò đã được chứng minh trong bệnh sinh VKDT. Gần đây, nó cũng cho thấy tác dụng ức chế quá trình chuyển đổi nguyên bào sợi sang nguyên bào sợi cơ trong BPMK/VKDT.
2. Nintedanib [7]
Nintedanib đã được phê duyệt để điều trị IPF, nó đã được chứng minh là làm chậm sự giảm FVC và giảm số lượng biến cố ngoại ý. Trong ống nghiệm, nintedanib đã chứng minh hiệu quả của nó trong việc giảm xơ phổi và bệnh khớp ở chuột cái bị VKDT.
Trong nghiên cứu INBUILD, thử nghiệm mù đôi, có đối chứng với giả dược, giai đoạn 3 nhằm đánh giá hiệu quả và độ an toàn của nintedanib trong bệnh BPMK xơ hóa tiến triển thứ phát sau các tình trạng khác ngoài IPF. Các chẩn đoán thường gặp nhất là viêm phổi quá mẫn mạn tính (26,1%) và bệnh BPMK tự miễn (25,6%), bao gồm cả bệnh nhân BPMK/VKDT. Những bệnh nhân được sử dụng nintedanib có tốc độ giảm FVC hàng năm chậm hơn trong khoảng thời gian 52 tuần so với giả dược. Các kết quả tương tự ở những bệnh nhân có mô sợi giống UIP hoặc các mô hình X quang hay mô học khác.
Vào năm 2018, một báo cáo trường hợp đầu tiên đã mô tả một nam 74 tuổi được chẩn đoán mắc bệnh BPMK/VKDT (kiểu hình UIP) được điều trị bằng nintedanib. Việc sử dụng nintedanib dẫn đến giảm ho cùng với giảm suy giảm FVC, từ −11,6%/năm xuống −5,2%/năm.
V. Điều trị bổ sung khác
Ở Châu Âu, pirfenidone được chấp thuận để điều trị IPF.
Pirfenidone làm giảm nồng độ IL6 và TNF-alpha, cả hai cytokine liên quan đến sự hoạt hóa của đại thực bào và với vai trò đã được chứng minh trong bệnh sinh VKDT. Gần đây, nó cũng cho thấy tác dụng ức chế quá trình chuyển đổi nguyên bào sợi sang nguyên bào sợi cơ trong BPMK/VKDT.
Tiên lượng & Những điểm chính
- Cơ chế xơ phổi trong BPMK/VKDT vẫn chưa được hiểu rõ.
- Mô bệnh học là tiêu chuẩn vàng chẩn đoán BPMK/VKDT.
- Điều trị BPMK/VKDT không giống như điều trị VKDT có bệnh đồng mắc là BPMK.
- Điều trị bổ sung bao gồm bỏ hút thuốc lá, quản lý bệnh trào ngược dạ dày-thực quản, tập phục hồi chức năng phổi, bổ sung oxy, tiêm phòng cúm và phế cầu.
Tài liệu tham khảo
- 01 Bộ y tế (2016). Hướng dẫn chẩn đoán và điều trị các bệnh cơ xương khớp. Nhà xuất bản Y học.
- 02 Bongartz T, Nannini C, Medina-Velasquez YF, et al. Incidence and mortality of interstitial lung disease in rheumatoid arthritis: a population-based study. Arthritis Rheum. 2010;62(6):1583-1591
- 03 3. Isabel Mira-Avendano, Andy Abril, Charles D. Burger, et al. Interstitial Lung Disease and Other Pulmonary Manifestations in Connective Tissue Diseases. Mayo Clin Proc. 2019;94(2):309-325
- 04 4. Megan Shaw, Bridget F. Collins, Lawrence A. Ho, Ganesh Raghu. Rheumatoid arthritis-associated lung disease. European Respiratory Review 2015 24: 1-16
- 05 5. Cavagna L, Monti S, Grosso V, et al. The multifaceted aspects of interstitial lung disease in rheumatoid arthritis. Biomed Res Int 2013; 2013: 759760
- 06 6. Elisabeth Bendstrup, Janne Müller, etal. Interstitial Lung Disease in Rheumatoid Arthritis Remains a Challenge for Clinicians. J. Clin. Med. 2019, 8, 2038
- 07 Giulia Cassone, Andreina Manfredi, et al. Treatment of Rheumatoid Arthritis-Associated Interstitial Lung Disease: Lights and Shadows. J Clin Med. 2020 Apr; 9(4): 1082.
- 08 8. Schupp J.C., Köhler T., Müller-Quernheim J. Usefulness of Cyclophosphamide Pulse Therapy in Interstitial Lung Diseases. Respiration. 2016;91:296–301
- 09 9. Kelly C., Young A., Ahmad Y., Dawson J., Carty S., Nisar M., Woodhead F. The effect of steroids, azathioprine and Mycophenolate on the risk of death in rheumatoid arthritis. Rheumatology. 2016;55:i99
- 10 10. Md Yusof, M.Y.; Kabia, A.; Darby, M.; Lettieri, G.; Beirne, P.; Vital, E.M.; Dass, S.; Emery, P. Effect of rituximab on the progression of rheumatoid arthritis-related interstitial lung disease: 10 years’ experience at a single centre. Rheumatology 2017, 56, 1348–1357
- 11 11. Flaherty K.R., Wells A.U., Cottin V., Devaraj A., Walsh S.L.F., Inoue Y., Richeldi L., Kolb M., Tetzlaff K., Stowasser S., et al. Nintedanib in Progressive Fibrosing Interstitial Lung Diseases. N. Engl. J. Med. 2019;381:1718–1727. doi: 10.1056/NEJMoa1908681

Cơ chế xơ phổi trong BPMK/VKDT vẫn chưa được hiểu rõ. Khuynh hướng di truyền và các yếu tố ngoài di truyền được cho là có vai trò nhất định. Một số bệnh nhân bị viêm khớp dạng thấp có thể có khuynh hướng di truyền với BPMK. HLA-B54, HLA-DQ1B * 0601, HLA-B40, HLA-DR4 và chất ức chế protease mã hóa vị trí α-1 có liên quan đến việc tăng nguy cơ BPMK trong VKDT, trong khi một số quyết định kháng nguyên (HLA- DRB1) có liên quan đến sự phát triển của bệnh VKDT nhưng giảm tỷ lệ BPMK/VKDT. Giới nam và lớn tuổi là những yếu tố nguy cơ của BPMK/VKDT. Cả hai yếu tố di truyền và hút thuốc đều có liên quan đến sự gia tăng sự citruline hóa của protein trong phổi, cho phép tiếp xúc với các quyết định kháng nguyên mới và phản ứng tự miễn dịch.

Hút thuốc lá cũng là một yếu tố nguy cơ của riêng bệnh viêm khớp dạng thấp và dẫn đến tổn thương lặp đi lặp lại đối với biểu mô phế nang và những thay đổi trong cytokine. Hút thuốc lá thúc đẩy sự tạo thành các protein ở phổi, do đó dẫn đến sự phát triển của các kháng thể kháng CCP. Điều này đặc biệt xảy ra đối với những người có chung HLA-DRB1.
Trong BPMK, phản ứng viêm kích hoạt các cytokine, chemokine và các yếu tố tăng trưởng, chẳng hạn như yếu tố hoại tử khối u (TNF: tumor necrosis factor), yếu tố tăng trưởng nội mô mạch máu (VEGF: vascular endothelial growth factor), yếu tố tăng trưởng có nguồn gốc từ tiểu cầu (PDGF: platelet derived growth factor) và interleukin (IL). Những điều này góp phần vào sự biệt hóa và tăng sinh của nguyên bào sợi, tăng tổng hợp và lắng đọng chất nền ngoại bào và tăng hoạt tính của chất nền metalloproteinase (MMP) dẫn đến BPMK. Nguyên bào sợi trong bao hoạt dịch có vai trò tương tự trong cơ chế bệnh sinh của các biểu hiện khớp của VKDT.
Khó thở khi gắng sức, ho, đau ngực, mệt mỏi
Khám lâm sàng có thể thấy ngón tay dùi trống (15%), nghe phổi có ran nổ Velcro hai bên ở BN BPMK có xơ hóa (72-100%)
Cần kết hợp lâm sàng và các xét nghiệm cận lâm sàng
I. Chức năng hô hấp
Khả năng khuếch tán khí qua màng phế nang mao mạch (DLCO) có giảm hoặc không.
Giảm oxy máu.
Hội chứng tắc nghẽn có thể có và được thấy ở những bệnh nhân có biểu hiện liên quan đến đường thở, ví dụ viêm phế quản tắc nghẽn.

II. Hình ảnh học
X quang lồng ngực là phương pháp không nhạy để phát hiện BPMK/VKDT. Có tới 64% bệnh nhân BPMK trên HRCT sẽ không có các thay đổi kẽ rõ ràng trên phim chụp X-quang lồng ngực [6]
Ở những bệnh nhân đã biết VKDT, và trong trường hợp lâm sàng không có nghi ngờ nhiễm trùng và/hoặc các biến chứng hô hấp khác thì HRCT có thể được sử dụng để chẩn đoán BPMK. Nhiều dạng khác nhau được thấy trên HRCT ở bệnh VKDT, trong đó phổ biến nhất là viêm phổi kẽ thông thường (UIP) chiếm 40–62% các trường hợp. Đây là một sự khác biệt đáng chú ý so với các bệnh mô liên kết khác, trong đó dạng viêm phổi mô kẽ không đặc hiệu (NSIP) thường thấy nhất. Hình ảnh UIP trong HRCT cho thấy tổn thương dưới màng phổi, ưu thế ở đáy phổi, với hình ảnh tổ ong, và giãn phế quản co kéo, tương đối ít tổn thương kính mờ (hình 2). NSIP là dạng phổ biến thứ hai, xảy ra ở ∼11–32% bệnh nhân. NSIP được đặc trưng bởi tổn thương dạng kính mờ và không có tổ ong (hình 3). Các dạng khác ít gặp hơn bao gồm viêm phổi tổ chức hóa, tổn thương phế nang lan tỏa (DAD), viêm phổi kẽ tế bào lympho (LIP) và viêm phổi mô kẽ bong vảy (DIP). Xơ phổi kết hợp và khí thũng (CPFE) cũng đã được phát hiện trên HRCT ở bệnh nhân VKDT. [4]

Hình 2: hình cắt ngang a) và cắt dọc b) ở BN BPMK/VKDT tổn thương dưới màng phổi, ưu thế ở đáy phổi, với hình ảnh tổ ong (mũi tên), và giãn phế quản co kéo, dày màng phổi
(đầu mũi tên)

Hình 3: Hình ảnh HRCT ở BN BPMK/VKDT với tổn thương kính mờ ở dưới màng phổi
III. Nội soi phế quản
Rửa phế quản phế nang trong nội soi phế quản để loại trừ nhiễm trùng và đánh giá đặc điểm tế bào viêm trong phổi. Tuy nhiên, các báo cáo về số lượng tế bào còn mơ hồ. Mặc dù số lượng tế bào lympho tăng trong dịch rửa phế quản phế nang, nhưng kết quả không nhất quán.
IV. Mô bệnh học
Là tiêu chuẩn vàng chẩn đoán BPMK/VKDT
Có thể thấy sự khác biệt nhỏ về mô bệnh học giữa UIP liên quan đến VKDT và UIP-xơ phổi vô căn; trong viêm khớp dạng thấp, UIP thường có ít nguyên bào sợi hơn và số lượng trung tâm mầm nhiều hơn. Điều này có thể không phải là duy nhất đối với UIP, vì số lượng tế bào T CD4 cao hơn đáng kể đã được mô tả trong các mẫu mô của cả UIP và NSIP khi so sánh với bệnh viêm phổi mô kẽ vô căn đơn thuần. Việc phân biệt giữa các dạng ILD có thể hữu ích trong việc tiên lượng vì bệnh nhân UIP hoặc DAD có tỷ lệ tử vong trong 5 năm cao hơn so với những bệnh nhân có các dạng như NSIP hoặc viêm phổi tổ chức hóa.
- Bệnh phổi do thuốc.
- Nhiễm trùng.
- Giãn phế quản.
- COPD.
- Suy tim sung huyết.
- Tràn dịch màng phổi.
- Bệnh ác tính (ung thư phổi, ung thư hạch).
- Đợt cấp trong BPMK/VKDT.
- Các bệnh nhu mô phổi liên quan đến hút thuốc lá.
- Nốt thấp.

Các chiến lược điều trị mới cho VKDT đã làm giảm hoạt động của bệnh, nhưng việc điều trị tối ưu sự liên quan đến phổi vẫn còn nan giải. Cho đến nay, không có thử nghiệm ngẫu nhiên có đối chứng nào trong BPMK/VKDT được thực hiện. Corticosteroid, azathioprine và mycophenolate là những lựa chọn điều trị được sử dụng rộng rãi nhất, với rituximab hoặc chất ức chế TNF-alpha là những lựa chọn thay thế ở những bệnh nhân bị bệnh khó chữa. Đáp ứng điều trị thường tốt hơn ở BPMK/VKDT có mô hình viêm. Bệnh xơ hóa, đặc biệt là VKDT-UIP, có xu hướng ít đáp ứng hơn và diễn biến của bệnh tương tự như xơ phổi vô căn (IPF) [6].
Chờ đợi hoặc bắt đầu điều trị là một thách thức trong BPMK/VKDT. Điều trị chủ yếu bắt đầu ở bệnh có ý nghĩa lâm sàng khi có bằng chứng về sự tiến triển của bệnh. Đánh giá triệu chứng, chức năng hô hấp, bao gồm đo DLCO là một phần của quá trình theo dõi. Theo dõi HRCT nên được hướng dẫn bởi các triệu chứng và suy giảm chức năng phổi. Khoảng thời gian theo dõi tối ưu không được biết và sẽ phụ thuộc vào diễn biến bệnh và phương pháp điều trị. Theo dõi 3–6 tháng một lần khi bệnh ổn định thường được áp dụng trong thực hành lâm sàng.
Phương pháp điều trị cho bệnh nhân BPMK/VKDT còn phức tạp do một số vấn đề chưa được giải quyết. Thứ nhất, cả thuốc DMARD và thuốc sinh học đều có liên quan đến sự phát triển của độc tính phổi liên quan đến thuốc với dữ liệu mâu thuẫn nhau; thứ hai, không có bằng chứng cho thấy việc điều trị VKDT có thể có hiệu quả đối với phổi. Ngược lại, các loại thuốc ức chế miễn dịch được sử dụng trong các bệnh mô liên kết (CTD) hoặc thuốc chống xơ hóa được chấp thuận cho bệnh xơ phổi vô căn (IPF) không có hiệu quả đối với bệnh viêm khớp. [7]
Điều trị BPMK/VKDT không giống như điều trị VKDT có bệnh đồng mắc là BPMK. [7]
I. Corticosteroid
Tác dụng của corticosteroid trên bệnh nhân UIP vẫn chưa rõ ràng.
II. Cyclophosphamide và Mycophenolate Mofetil
Không có thử nghiệm lâm sàng đối chứng nào đối với Cyclophosphamide (CYC) trong BPMK/VKDT, nhưng nó được sử dụng trong thực hành lâm sàng mặc dù dữ liệu về hiệu quả hạn chế [8], đặc biệt trong trường hợp ILD tiến triển nhanh.
Vì CYC cho thấy ít lợi ích đối với BPMK/VKDT, nó thường được kết hợp với corticosteroid hoặc các chất ức chế miễn dịch khác.
Mycophenolate mofetil (MMF) được coi là sự thay thế chính cho CYC như một tác nhân đầu tay hoặc một liệu pháp duy trì có thể có trong CTD-ILD, với tỷ lệ tác dụng phụ thấp hơn CYC. Năm 2016, một nghiên cứu hồi cứu từ Vương quốc Anh cho thấy khả năng sống tốt hơn ở những bệnh nhân được điều trị bằng MMF so với azathioprine (AZA). Nguy cơ tử vong tương đối vì bất kỳ nguyên nhân nào đều tăng đối với bệnh nhân dùng prednisone, không thay đổi đối với AZA và giảm đối với MMF. Các tác giả đề xuất MMF tốt hơn là CS hoặc AZA để điều trị BPMK/VKDT [9].
III. Thuốc sinh học
Rituximab (RTX), một kháng thể kháng CD20 làm suy giảm tế bào B, đã được sử dụng cho 700 BN bị VKDT; 56 BN bị BPMK/VKDT trước khi điều trị rituximab. 68% những bệnh nhân này đã cải thiện hoặc có chức năng phổi ổn định sau rituximab.
Rituximab an toàn và chỉ có ba bệnh nhân (0,4%) phát triển BPMK sau khi điều trị bằng RTX, điều này có thể chỉ ra tác dụng bảo vệ của rituximab [10]. Một phản ứng tương tự đã được thấy trong loạt trường hợp nhỏ hơn. Do đó, rituximab có thể hữu ích ở những bệnh nhân mắc BPMK/Bệnh mô liên kết.
Việc sử dụng liệu pháp ức chế TNF-alpha trong BPMK/VKDT cũng giới hạn trong những báo cáo loạt ca, cho thấy có sự ổn định BPMK.
IV. Thuốc chống xơ
BPMK/VKDT có một số điểm tương đồng với xơ phổi vô căn (IPF), đặc biệt là ở những bệnh nhân có mô hình UIP.
Thử nghiệm INBUILD đã đánh giá hiệu quả và tính an toàn của nintedanib ở những bệnh nhân được chẩn đoán BPMK không phải xơ phổi vô căn, bao gồm cả VKDT [11]. Hơn nữa, một số thử nghiệm đã được lên kế hoạch hoặc đang tiến hành để đánh giá hiệu quả và tính an toàn của các thuốc chống xơ hóa trong điều trị BPMK xơ hóa ngoài IPF, bao gồm cả những bệnh nhân bị VKDT.
1. Pirfenidone [7]
Ở Châu Âu, pirfenidone được chấp thuận để điều trị IPF.
Pirfenidone làm giảm nồng độ IL6 và TNF-alpha, cả hai cytokine liên quan đến sự hoạt hóa của đại thực bào và với vai trò đã được chứng minh trong bệnh sinh VKDT. Gần đây, nó cũng cho thấy tác dụng ức chế quá trình chuyển đổi nguyên bào sợi sang nguyên bào sợi cơ trong BPMK/VKDT.
2. Nintedanib [7]
Nintedanib đã được phê duyệt để điều trị IPF, nó đã được chứng minh là làm chậm sự giảm FVC và giảm số lượng biến cố ngoại ý. Trong ống nghiệm, nintedanib đã chứng minh hiệu quả của nó trong việc giảm xơ phổi và bệnh khớp ở chuột cái bị VKDT.
Trong nghiên cứu INBUILD, thử nghiệm mù đôi, có đối chứng với giả dược, giai đoạn 3 nhằm đánh giá hiệu quả và độ an toàn của nintedanib trong bệnh BPMK xơ hóa tiến triển thứ phát sau các tình trạng khác ngoài IPF. Các chẩn đoán thường gặp nhất là viêm phổi quá mẫn mạn tính (26,1%) và bệnh BPMK tự miễn (25,6%), bao gồm cả bệnh nhân BPMK/VKDT. Những bệnh nhân được sử dụng nintedanib có tốc độ giảm FVC hàng năm chậm hơn trong khoảng thời gian 52 tuần so với giả dược. Các kết quả tương tự ở những bệnh nhân có mô sợi giống UIP hoặc các mô hình X quang hay mô học khác.
Vào năm 2018, một báo cáo trường hợp đầu tiên đã mô tả một nam 74 tuổi được chẩn đoán mắc bệnh BPMK/VKDT (kiểu hình UIP) được điều trị bằng nintedanib. Việc sử dụng nintedanib dẫn đến giảm ho cùng với giảm suy giảm FVC, từ −11,6%/năm xuống −5,2%/năm.
V. Điều trị bổ sung khác
Ở Châu Âu, pirfenidone được chấp thuận để điều trị IPF.
Pirfenidone làm giảm nồng độ IL6 và TNF-alpha, cả hai cytokine liên quan đến sự hoạt hóa của đại thực bào và với vai trò đã được chứng minh trong bệnh sinh VKDT. Gần đây, nó cũng cho thấy tác dụng ức chế quá trình chuyển đổi nguyên bào sợi sang nguyên bào sợi cơ trong BPMK/VKDT.
- Cơ chế xơ phổi trong BPMK/VKDT vẫn chưa được hiểu rõ.
- Mô bệnh học là tiêu chuẩn vàng chẩn đoán BPMK/VKDT.
- Điều trị BPMK/VKDT không giống như điều trị VKDT có bệnh đồng mắc là BPMK.
- Điều trị bổ sung bao gồm bỏ hút thuốc lá, quản lý bệnh trào ngược dạ dày-thực quản, tập phục hồi chức năng phổi, bổ sung oxy, tiêm phòng cúm và phế cầu.
- 01 Bộ y tế (2016). Hướng dẫn chẩn đoán và điều trị các bệnh cơ xương khớp. Nhà xuất bản Y học.
- 02 Bongartz T, Nannini C, Medina-Velasquez YF, et al. Incidence and mortality of interstitial lung disease in rheumatoid arthritis: a population-based study. Arthritis Rheum. 2010;62(6):1583-1591
- 03 3. Isabel Mira-Avendano, Andy Abril, Charles D. Burger, et al. Interstitial Lung Disease and Other Pulmonary Manifestations in Connective Tissue Diseases. Mayo Clin Proc. 2019;94(2):309-325
- 04 4. Megan Shaw, Bridget F. Collins, Lawrence A. Ho, Ganesh Raghu. Rheumatoid arthritis-associated lung disease. European Respiratory Review 2015 24: 1-16
- 05 5. Cavagna L, Monti S, Grosso V, et al. The multifaceted aspects of interstitial lung disease in rheumatoid arthritis. Biomed Res Int 2013; 2013: 759760
- 06 6. Elisabeth Bendstrup, Janne Müller, etal. Interstitial Lung Disease in Rheumatoid Arthritis Remains a Challenge for Clinicians. J. Clin. Med. 2019, 8, 2038
- 07 Giulia Cassone, Andreina Manfredi, et al. Treatment of Rheumatoid Arthritis-Associated Interstitial Lung Disease: Lights and Shadows. J Clin Med. 2020 Apr; 9(4): 1082.
- 08 8. Schupp J.C., Köhler T., Müller-Quernheim J. Usefulness of Cyclophosphamide Pulse Therapy in Interstitial Lung Diseases. Respiration. 2016;91:296–301
- 09 9. Kelly C., Young A., Ahmad Y., Dawson J., Carty S., Nisar M., Woodhead F. The effect of steroids, azathioprine and Mycophenolate on the risk of death in rheumatoid arthritis. Rheumatology. 2016;55:i99
- 10 10. Md Yusof, M.Y.; Kabia, A.; Darby, M.; Lettieri, G.; Beirne, P.; Vital, E.M.; Dass, S.; Emery, P. Effect of rituximab on the progression of rheumatoid arthritis-related interstitial lung disease: 10 years’ experience at a single centre. Rheumatology 2017, 56, 1348–1357
- 11 11. Flaherty K.R., Wells A.U., Cottin V., Devaraj A., Walsh S.L.F., Inoue Y., Richeldi L., Kolb M., Tetzlaff K., Stowasser S., et al. Nintedanib in Progressive Fibrosing Interstitial Lung Diseases. N. Engl. J. Med. 2019;381:1718–1727. doi: 10.1056/NEJMoa1908681